Правильно готовим растворы
Правильно готовим растворы
Приготовление растворов – это фундаментальный навык, необходимый во множестве областей, от бытовой химии и кулинарии до научных исследований и промышленных процессов. От точности приготовления зависит конечный результат: будь то эффективность моющего средства, вкус блюда, надежность эксперимента или качество произведенного продукта. Неправильно приготовленный раствор может оказаться неэффективным, вредным или вовсе бесполезным. Поэтому освоение правил и техник приготовления растворов является ключевым для достижения желаемого.
Основной принцип приготовления любого раствора заключается в правильном соотношении растворителя и растворяемого вещества. Растворитель – это вещество, которое способно растворять другое вещество, образуя раствор. Чаще всего в качестве растворителя выступает вода, благодаря ее универсальности и доступности. Однако, в зависимости от природы растворяемого вещества, могут использоваться и другие растворители, такие как спирты (этанол, изопропанол), эфиры, ацетон, глицерин и многие другие. Выбор растворителя зависит от химических свойств растворяемого вещества. Например, полярные вещества, такие как соли и сахара, хорошо растворяются в полярных растворителях, в первую очередь в воде. Неполярные вещества, такие как масла и жиры, наоборот, лучше растворяются в неполярных растворителях, например, в бензине или гексане.
Растворяемое вещество – это то, что мы добавляем в растворитель. Оно может быть в твердом, жидком или газообразном состоянии. Приготовление раствора предполагает равномерное распределение частиц растворяемого вещества в объеме растворителя.
Существуют различные виды растворов, классифицируемых по концентрации. Концентрация раствора – это мера содержания растворяемого вещества в определенном количестве раствора или растворителя. Наиболее распространенные способы выражения концентрации включают:
- Массовая доля (w): Отношение массы растворяемого вещества к общей массе раствора, выраженное в процентах или долях единицы. Формула: w = (масса растворяемого вещества / масса раствора) * 100%. Например, 10% раствор соли означает, что в 100 граммах раствора содержится 10 грамм соли и 90 грамм воды.
- Объемная доля (φ): Отношение объема растворяемого вещества к общему объему раствора, выраженное в процентах. Часто используется для растворов жидкостей. Формула: φ = (объем растворяемого вещества / объем раствора) * 100%. Например, 40% спиртовой раствор означает, что в 100 мл раствора содержится 40 мл спирта и 60 мл воды.
- Молярная концентрация (M): Количество вещества (в молях) на единицу объема раствора (обычно литр). Формула: M = n / V, где n – количество вещества в молях, V – объем раствора в литрах. Молярная концентрация очень важна в химии, так как она отражает количество частиц вещества. Например, 1 M раствор NaCl содержит 1 моль NaCl в 1 литре раствора.
- Нормальная концентрация (N): Количество эквивалентов вещества на единицу объема раствора. Используется для реакций с участием кислот, оснований и окислителей/восстановителей.
- Массовая концентрация (ρ): Масса растворяемого вещества на единицу объема раствора. Формула: ρ = m / V, где m – масса растворяемого вещества, V – объем раствора.
Для приготовления растворов требуются точные измерения. Это означает использование соответствующей лабораторной посуды и инструментов: мерные колбы, мерные цилиндры, пипетки, бюретки, весы (аналитические или технические, в зависимости от требуемой точности).
Этапы приготовления раствора:
- Определение цели и требуемой концентрации: Прежде всего, необходимо четко понимать, какой раствор вам нужен и с какой концентрацией. Это определяет количество компонентов.
- Выбор растворителя: Исходя из свойств растворяемого вещества, выбирается подходящий растворитель.
- Точное взвешивание или отмеривание компонентов: Используйте весы для точного взвешивания твердых веществ. Для жидкостей используйте мерные цилиндры или пипетки. Если требуется высокая точность, особенно при работе с малыми объемами, предпочтительнее использовать пипетки (градуированные или дозировочные).
- Растворение: Растворяемое вещество добавляется в растворитель. Процесс растворения может ускоряться при перемешивании (например, с помощью стеклянной палочки или магнитной мешалки) и/или нагревании. Однако, следует помнить, что нагревание не всегда желательно, так как оно может привести к испарению растворителя или разложению растворяемого вещества. Важно убедиться, что вещество полностью растворилось.
- Доведение до нужного объема (при приготовлении растворов заданной концентрации по объему): Если вы готовите раствор определенного объема (например, 100 мл 10% раствора), то после растворения вещества, долив растворителя до нужной отметки, вы получаете конечный раствор. Важно учитывать, что при добавлении растворяемого вещества объем раствора может немного изменяться. Поэтому, если требуется точный конечный объем, лучше сначала отмерить часть растворителя, растворить в нем вещество, а затем долить растворитель до нужного объема в мерной посуде.
- Перемешивание: После доведения до нужного объема раствор необходимо тщательно перемешать, чтобы обеспечить однородность. Обычно это делается путем переворачивания закрытой мерной колбы несколько раз.
- Маркировка: Все приготовленные растворы должны быть четко промаркированы. На этикетке указывается название вещества, его концентрация, дата приготовления и, при необходимости, имя исполнителя.
Примеры практического применения:
- В быту: Приготовление моющих растворов (например, раствора отбеливателя или средства для мытья посуды), растворов для дезинфекции, сиропов для выпечки. Например, для приготовления простого сахарного сиропа для пропитки бисквита, смешивают сахар и воду в определенном соотношении (например, 1:1 или 2:1 по массе) и нагревают до полного растворения сахара.
- В медицине: Приготовление лекарственных растворов, инфузионных растворов, растворов для инъекций. Здесь точность имеет первостепенное значение, так как от нее зависит дозировка и эффективность лекарства. Например, приготовление физиологического раствора (0.9% раствор NaCl) для внутривенных вливаний требует строгого соблюдения концентрации.
- В кулинарии: Приготовление маринадов, соусов, бульонов, растворов для консервирования. Правильное соотношение ингредиентов, включая соль, сахар, уксус, специи, определяет конечный вкус и текстуру продукта.
- В науке: Приготовление стандартных растворов для аналитических методов, реактивов для химических экспериментов, питательных сред для микробиологии. В научных исследованиях точность приготовления растворов критически важна для получения достоверных и воспроизводимых результатов. Например, при приготовлении стандартного раствора для титрования, необходимо точно взвесить навеску вещества и растворить его в мерной колбе определенного объема.
Важные нюансы и меры предосторожности:
- Чистота посуды: Используйте только чистую посуду, чтобы избежать загрязнения раствора.
- Порядок добавления: В большинстве случаев растворяемое вещество добавляется в растворитель, а не наоборот. Это позволяет лучше контролировать процесс растворения и избегать разбрызгивания.
- Температура: Температура может влиять на растворимость веществ. Некоторые вещества лучше растворяются при нагревании, другие – при охлаждении.
- Безопасность: При работе с агрессивными или токсичными веществами необходимо соблюдать меры предосторожности: использовать перчатки, защитные очки, работать в вытяжном шкафу. Всегда ознакамливайтесь с паспортом безопасности вещества перед началом работы.
- Тиксотропия и реологические свойства: При приготовлении некоторых растворов, особенно в промышленности, важно учитывать их реологические свойства – как раствор течет под действием силы. Некоторые растворы могут проявлять тиксотропию (изменение вязкости при механическом воздействии), что влияет на их поведение при перемешивании, перекачивании и нанесении.
Правильное приготовление растворов – это искусство, требующее внимания к деталям, понимания принципов химии и аккуратности. Освоив эти навыки, вы сможете с уверенностью решать множество задач в различных сферах деятельности.
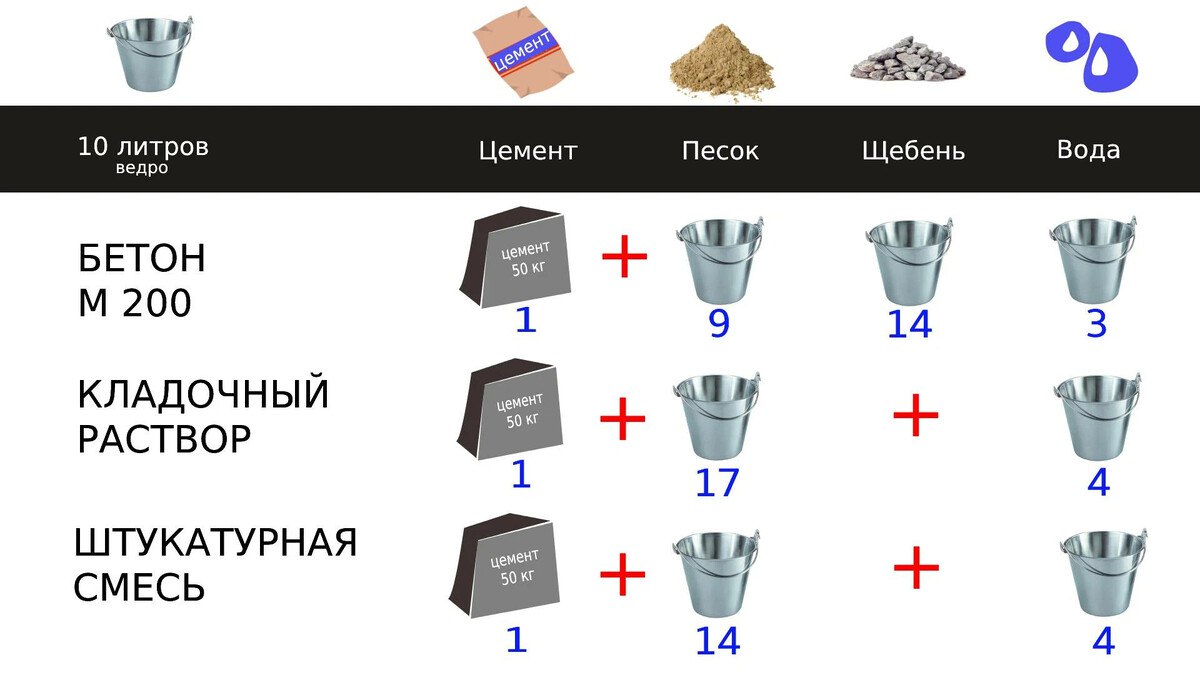


Добавить комментарий